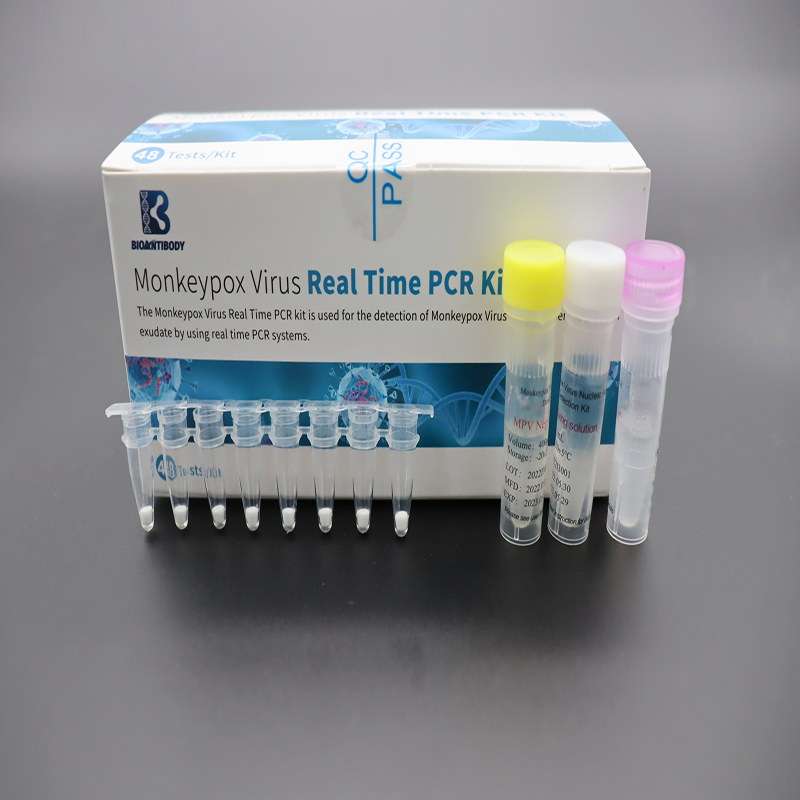
Monkeypox Virus Real Time PCR Kit
Termék leírás
Rendeltetésszerű használat
A majomhimlő vírus kimutatására szolgál emberi szérum- vagy lézióváladék-mintákban valós idejű PCR-rendszerek segítségével.
Teszt elve
Ez a termék egy fluoreszcens szondán alapuló Taqman® valós idejű PCR vizsgálati rendszer.A majomhimlő vírus F3L génjének kimutatására speciális primereket és próbákat terveztek.A humán konzervált gént megcélzó belső kontroll figyeli a mintagyűjtést, a mintakezelést és a valós idejű PCR folyamatot, hogy elkerülje a hamis negatív eredményeket.A készlet egy teljesen premix liofilizált rendszer, amely tartalmazza a majomhimlő vírus kimutatásához szükséges anyagokat: nukleinsavamplifikációs enzimet, UDG enzimet, reakciópuffert, specifikus primert és szondát.
Fő tartalom
A megadott komponensek a táblázatban vannak felsorolva.
| Alkatrészek | Csomag | Hozzávaló |
| Majomhimlő vírusLiofilizált premix | 8 csíkos PCR cső× 6 tasak | Primerek, próbák, dNTP/dUTP keverék, Mg2+, Taq DNS polimeráz, UDG enzim |
| MPV pozitív kontroll | 400 μl × 1 cső | Target gént tartalmazó DNS-szekvenciák |
| MPV negatív kontroll | 400 μl × 1 cső | Humán génszegmenst tartalmazó DNS-szekvenciák |
| Oldóoldat | 1 ml × 1 cső | Stabilizátor |
| Megfelelőségi tanúsítvány | 1 darab | / |
Flow művelet
1. MintaGyűjtemény:A mintát steril csövekbe kell gyűjteni ennek megfelelően
szabványos műszaki előírásokkal.
2. Reagens előkészítés (reagens előkészítési terület)
Vegye ki a készlet alkatrészeit, és szobahőmérsékleten egyensúlyozza ki őket készenléti használatra.
3. Mintafeldolgozás (mintafeldolgozási terület)
3.1 Nukleinsav extrakció
A nukleinsav extrakcióhoz 200 μL folyékony minták, pozitív kontroll és negatív kontroll vétele javasolt, a vírus DNS extrakciós kitekre vonatkozó követelményeknek és eljárásoknak megfelelően.
3.2 Liofilizált por feloldása és sablon hozzáadása
Készítsen Monkeypox Virus liofilizált premixet a minták számának megfelelően.Egy mintához egy liofilizált premix port tartalmazó PCR cső szükséges.A negatív és a pozitív kontrollt két mintaként kell kezelni.
(1) Adjon 15 μL feloldó oldatot minden liofilizált premixet tartalmazó PCR-csőbe, majd adjon 5 μL extrahált mintát/negatív kontrollt/pozitív kontrollt mindegyik PCR-csőbe.
(2) Fedje le szorosan a PCR-csöveket, pöccintse meg kézzel a PCR-csöveket, amíg a liofilizált por teljesen fel nem oldódik és összekeveredett, majd azonnali kis sebességű centrifugálással gyűjtse össze a folyadékot a PCR-csövek aljára.
(3) Ha általános valós idejű PCR-műszert használ a kimutatáshoz, akkor közvetlenül vigye át a PCR csöveket az amplifikációs területre;Ha a detektáláshoz BTK-8-at használ, akkor a következő műveleteket kell végrehajtania: 10 μL folyadékot vigyen át a PCR csőből a BTK-8 reakcióchip üregébe.Egy PCR-cső a chipen lévő egy lyuknak felel meg.A pipettázás során ügyeljen arra, hogy a pipetta függőlegesen 90 fokkal álljon.Az aeroszolzáró pipettahegyeket mérsékelt erővel kell a mélyedés közepére helyezni, és abba kell hagyni a pipetta nyomását, amikor eléri az első fokozatot (a buborékok elkerülése érdekében).A lyukak feltöltése után vegyen ki egy reakcióchip membránt, hogy az összes lyukat befedje, majd a chipet átvisszük az amplifikáció detektálási területére.
4. PCR-amplifikáció (kimutatási terület)
4.1 Helyezze a PCR csöveket/reakcióchipet a reakciótartályba, és állítsa be az egyes reakciólyukak nevét a megfelelő sorrendben.
4.2 A kimutatási fluoreszcencia beállításai: (1) Monkeypox virus (FAM);(2) Belső ellenőrzés (CY5).
4.3 Futtassa a következő kerékpározási protokollt
ABI7500, Bio-Rad CFX96, SLAN-96S, QuantStudio protokoll:
| Lépések | Hőfok | Idő | Ciklusok | |
| 1 | Elődenaturáció | 95℃ | 2 perc | 1 |
| 2 | Denaturáció | 95℃ | 10 s | 45 |
| Lágyítás, nyújtás, fluoreszcencia felvétel | 60℃ | 30 s | ||
A BTK-8 protokollja:
| Lépések | Hőfok | Idő | Ciklusok | |
| 1 | Elődenaturáció | 95℃ | 2 perc | 1 |
| 2 | Denaturáció | 95℃ | 5 s | 45 |
| Lágyítás, nyújtás, fluoreszcencia felvétel | 60℃ | 14 s | ||
5. Az eredmények elemzése (lásd a műszer használati útmutatóját)
A reakció után az eredmények automatikusan mentésre kerülnek.Kattintson az „Elemzés” elemre az elemzéshez, és a műszer automatikusan értelmezi minden egyes minta Ct értékét az eredmény oszlopban.A negatív és pozitív kontrolleredményeknek meg kell felelniük a következő "6. Minőségellenőrzés" pontnak.
6. Minőség ellenőrzés
6.1 Negatív kontroll: Nincs Ct vagy Ct>40 a FAM csatornában, Ct≤40 a CY5 csatornában normál erősítési görbével.
6.2 Pozitív kontroll: Ct≤35 a FAM csatornában normál erősítési görbével, Ct≤40 a CY5 csatornában normál erősítési görbével.
6.3 Az eredmény akkor érvényes, ha a fenti kritériumok mindegyike teljesül.Ellenkező esetben az eredmény érvénytelen.
Eredmény értelmezése
A következő eredmények lehetségesek:
| FAM csatorna Ct értéke | A CY5 csatorna Ct értéke | Értelmezés | |
| 1# | Nincs Ct vagy Ct>40 | ≤40 | Monkeypox vírus negatív |
| 2# | ≤40 | Bármilyen eredmény | Monkeypox vírus pozitív |
| 3# | 40-45 | ≤40 | Újrateszt;ha még mindig 40-45, jelentse 1#-ként |
| 4# | Nincs Ct vagy Ct>40 | Nincs Ct vagy Ct>40 | Érvénytelen |
JEGYZET: Ha érvénytelen eredmény adódik, a mintát össze kell gyűjteni és újra meg kell vizsgálni.
Rendelési információ
| termék név | Macska.Nem | Méret | Mintadarab | Szavatossági idő | Trans.& Sto.Temp. |
| Monkeypox Virus Real Time PCR Kit | B001P-01 | 48 teszt/készlet | Szérum/lézió váladék | 12 hónap | -25 ~-15 ℃ |